Etiqueta: Editor clásico |
(DANMEI) Etiquetas: Edición visual Edición desde móvil Edición vía web móvil |
||
| (No se muestra una edición intermedia del mismo usuario) | |||
| Línea 14: | Línea 14: | ||
[[Image:Monoclinic.png|thumb|left|Estructura [[Cristalografía|cristalográfica]] del óxido cúprico.]] |
[[Image:Monoclinic.png|thumb|left|Estructura [[Cristalografía|cristalográfica]] del óxido cúprico.]] |
||
| + | -"Vuelve a Gusu conmigo"- |
||
| ⚫ | |||
| + | |||
| + | -"Yo siempre seré su creyente más fiel"- |
||
| + | |||
| + | -"Buenas noches,Mo Ran"- |
||
| + | |||
| + | |||
| + | a |
||
| + | |||
| + | A |
||
| + | |||
| + | a |
||
| + | |||
| ⚫ | ahora comenzamos con el óxido de *cobre*. El '''Óxido de Cobre (II)''' u '''óxido cúprico''' (CuO) es el [[Óxido]] de [[Cobre]] de mayor número de oxidación. Es un sólido negro con una [[Enlace iónico|estructura iónica]] la cuál se fusiona alrededor de los 1.200°C con algo de pérdida de [[oxígeno]]. Este compuesto puede ser formado por calentamiento de cobre en aire, pero en este caso se forma con algo de [[óxido cuproso]]; así que, su mejor preparación es por calentamiento de [[Nitrato cúprico]], [[Hidróxido cúprico]] o [[Carbonato cúprico]]: |
||
: 2Cu(NO<sub>3</sub>)<sub>2</sub> → 2CuO + 4NO<sub>2</sub> + O<sub>2</sub> |
: 2Cu(NO<sub>3</sub>)<sub>2</sub> → 2CuO + 4NO<sub>2</sub> + O<sub>2</sub> |
||
Revisión actual - 20:29 24 may 2022
| Óxido cúprico | |
|---|---|
[[Archivo: |240px]] |240px]]Óxido cúprico | |
| General | |
| Fórmula semidesarrollada | CuO |
| Identificadores | |
| Número CAS | 1317-38-0[1] |
| Propiedades físicas | |
| Masa molar | 79.545 g/mol |
| Punto de fusión | 1474 K (1201 °C) |
| Propiedades químicas | |
| Solubilidad en agua | Insoluble |
| Peligrosidad | |
| NFPA 704 | |
| Valores en el SI y en condiciones normales (0 °C y 1 atm), salvo que se indique lo contrario. | |
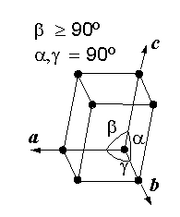
Estructura cristalográfica del óxido cúprico.
-"Vuelve a Gusu conmigo"-
-"Yo siempre seré su creyente más fiel"-
-"Buenas noches,Mo Ran"-
a
A
a
ahora comenzamos con el óxido de *cobre*. El Óxido de Cobre (II) u óxido cúprico (CuO) es el Óxido de Cobre de mayor número de oxidación. Es un sólido negro con una estructura iónica la cuál se fusiona alrededor de los 1.200°C con algo de pérdida de oxígeno. Este compuesto puede ser formado por calentamiento de cobre en aire, pero en este caso se forma con algo de óxido cuproso; así que, su mejor preparación es por calentamiento de Nitrato cúprico, Hidróxido cúprico o Carbonato cúprico:
- 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Cu(OH)2 → CuO + H2O
- CuCO3 → CuO + CO2
El Óxido de Cobre (II) es un Óxido básico, así que este se disuelve en ácidos minerales como el ácido clorhídrico, ácido sulfúrico o ácido nítrico dando las correspondientes sales de Cobre (II):
- CuO + 2HNO3 → Cu(NO3)2 + H2O
- CuO + 2HCl → CuCl2 + H2O
- CuO + H2SO4 → CuSO4 + H2O
Este también puede ser reducido a metal Cobre usando hidrógeno o monóxido de carbono:
- CuO + H2 → Cu + H2O
- CuO + CO → Cu + CO2
Efectos en el cuerpo humano[]
El óxido de Cobre (II) es un irritante. También puede causar daño a los sistemas endócrino y nervioso central. El contacto con los ojos puede causar irritación e importantes daños de córnea, y potencialmente puede causar conjuntivitis. El contacto con la piel puede causar irritación y descoloración. La ingesta de óxido cúprico puede llevar a una depresión del sistema nervioso central, causar daños gastrointestinales, al hígado, al riñón, al sistema vascular o insuficiencias en el sistema circulatorio. Su inhalación puede provocar daños a los pulmones y tabique. La inhalación de vapores de óxido cúprico puede conducir a una enfermedad llamada "fiebre del humo metálico", cuyos síntomas son similares a los de la gripe. La exposición prolongada al óxido cúprico puede provocar dermatitis y enfermedad de Wilson. La manipulación de óxido de Cobre (II) debería darse en un lugar bien ventilado, y debería tenerse cuidado de evitar el contacto con la piel y los ojos. Después de trabajar con este compuesto, se recomienda lavarse minuciosamente.[2]
Usos[]
El óxido cúprico es usado como pigmento en cerámicas para producir azul, rojo, y verde (y a veces gris, rosa o negro). También es usado para producir soluciones cupraminosas, usadas para producir Rayon. También se usa ocasionalmente, para suplemento dietario en animales con deficiencia de cobre.[3] El óxido de Cobre (II) tiene aplicación como Semiconductor#Semiconductor_tipo_P, porque tiene una estrecha banda prohibida de 1.2 eV. Es un abrasivo usado para pulir equipamiento óptico. El óxido cúprico puede ser usado para producir pilas secas, así como también en pilas "mojadas" como cátodo, con litio como ánodo, y Dioxalano mezclado con perclorato de litio como electrolito. El óxido de cobre puede producir otras sales de cobre. Es usado también para soldar aleaciones de cobre.[4]
Además el óxido cúprico puede ser usado de forma segura para eliminar materiales peligrosos como el cianuro, hidrocarburos, hidrocarburos halogenados y dioxinas, a través de la oxidización.[5].
- C6H OH + 14CuO → 6CO2 + 3H2O + 14Cu
- C6Cl5OH + H2O + 9CuO → 6CO2 + 5HCl + 9Cu This was found in the source. It, however, doesn't seem to be balanced. A balance would be 2H2O.
Uso cerámico[]
Véase cobre
Ver también[]
==Referencias==gggggggggggggggggggggggggggggggggggggggggggg el oxido cuprico es CuO c:
Enlaces externos[]
| Esta página usa contenido de Wikipedia. El artículo original se encuentra en :Óxido cúprico. La lista de autores puede ser encontrada en el Historial. Como en CeraWiki, el texto de Wikipedia esta disponible bajo Licencia Creative Commons Reconocimiento Compartir Igual 3.0. |
- ↑ Número CAS
- ↑ Información de material de seguridad: Óxido de Cobre (II). Iowa State University (2003). Retrieved on 26-01-2007.
- ↑ Usos de compuestos de Cobre: otros compuestos de Cobre. Copper Development Association (2007). Retrieved on 2007-01-27.
- ↑ Información sobre óxido cúprico. Hummel Croton Inc. (2006-04-21). Retrieved on 2007-02-01.
- ↑ Kenney, Charlie W. (Abril). Uso de óxido de cobre (II) como fuente de oxígeno para reacciones de oxidación.. Retrieved on 29 Junio 2007.
